
- Heim
- Emilys Geschichte
- Über uns
- Forschung
- Veranstaltungen
- Presse & Medien
- Werde aktiv
- Der Blog
- Kontakt
- Spenden

Befürwortung
Die Bedürfnisse der Finalisten im Blick 10%
Das Eintreten für und die Vertretung der letzten 10% der CF-Gemeinschaft ist ein entscheidender Teil des Auftrags von EE. Während sich EE im Laufe der Jahre einen wohlverdienten Ruf als effektiver Fürsprecher für Forschung und therapeutische Entwicklung für die letzten 10% der Mukoviszidose-Gemeinschaft erworben hatte, wuchs die Erkenntnis über ihren einzigartigen Wert im Bereich der Regulierung - und insbesondere bei wichtigen Regulierungsbehörden wie der Food & Drug Administration (FDA).
Im Jahr 2021 setzte sich EE bei der FDA dafür ein, dass Veranstaltung einer FDA-Patientenanhörung. Dies war ein wichtiger Schritt für die Organisation. Der Ansatz von EE bei der Interessenvertretung hat schon immer den Patienten in den Mittelpunkt gestellt und arbeitet Seite an Seite mit der wissenschaftlichen Gemeinschaft. Die Zusammenarbeit mit der FDA bei einer Sitzung, die sich speziell auf die ungedeckten Bedürfnisse der letzten 10% der Mukoviszidose-Gemeinschaft konzentrierte, spiegelte die einflussreiche, wachsende Stimme von EE in mehreren Bereichen wider, die für die therapeutische Entwicklung von entscheidender Bedeutung sind, einschließlich des regulatorischen Bereichs.

FDA-Patientenanhörungen sind kleine, informelle Treffen unter Ausschluss der Öffentlichkeit, bei denen Patientenvertretungsgruppen mit FDA-Mitarbeitern über ihre Erfahrungen mit dem Leben und dem Umgang mit einer Krankheit sprechen. Die Ziele der EE-Anhörung waren, den dringenden, unerfüllten therapeutischen Bedarf, der für die letzten 10% der Mukoviszidose-Gemeinschaft besteht, mitzuteilen und zu vermenschlichen, eine starke Beziehung zur FDA aufzubauen, um eine Priorisierung und beschleunigte behördliche Überprüfungen und Zulassungen in der Zukunft zu fördern, und sicherzustellen, dass die Perspektiven der Mukoviszidose-Gemeinschaft in jeder Phase der Arzneimittelentwicklung und des Zulassungsverfahrens einbezogen werden.
Bei dem Treffen informierte EE die Mitarbeiter der FDA über EE, CF und die verbleibenden 10% der CF-Gemeinschaft, die nicht von den derzeit verfügbaren CFTR-Modulatoren profitieren, einschließlich derjenigen mit CF-Nonsense-Mutationen. Auf der Veranstaltung sprachen ein Kliniker sowie sechs Mitglieder der CF-Gemeinschaft, darunter Menschen mit Mukoviszidose, Eltern und Geschwister von Menschen mit Mukoviszidose sowie ein Elternteil eines verstorbenen Menschen mit Mukoviszidose, die ihre Erfahrungen mit der Krankheit schilderten. Diese sehr persönlichen und zu Herzen gehenden Geschichten halfen, der FDA die Dringlichkeit der Suche nach Behandlungsmöglichkeiten für die verbleibenden 10% der CF-Gemeinschaft zu vermitteln.
Geschichten, die in den Anhörungen der FDA hervorgehoben wurden:
Im Rahmen der FDA-Anhörung hörten die Teilnehmer sechs Mitglieder der Mukoviszidose-Gemeinschaft, darunter Abhijit Tirumala, ein 19-jähriger Student mit Mukoviszidose. In seiner Aussage erzählte Abhijit, wie sich Mukoviszidose auf seine psychische Gesundheit auswirkt und wie sich sein Leben verändern würde, wenn ein neues Medikament seine Abhängigkeit von täglichen Behandlungen und Medikamenten verringern könnte.

Im Juni 2021 führte EE seine erste umfassende, globale Umfrage unter den etwa 10% Personen in der CF-Gemeinschaft durch, die von den derzeit verfügbaren CFTR-Modulatoren nicht profitieren, weil sie nicht in Frage kommende Mutationen aufweisen, Nebenwirkungen haben oder keinen Zugang dazu haben. Ziel der "Final 10%"-Umfrage war es, Informationen über den Gesundheitszustand, die Auswirkungen der Mukoviszidose, den ungedeckten Behandlungsbedarf und die Präferenzen in der klinischen Forschung bei denjenigen zu sammeln, die nicht von CFTR-Modulatoren profitieren, und die vorläufigen Daten und Ergebnisse auf der FDA-Anhörungssitzung zu präsentieren.
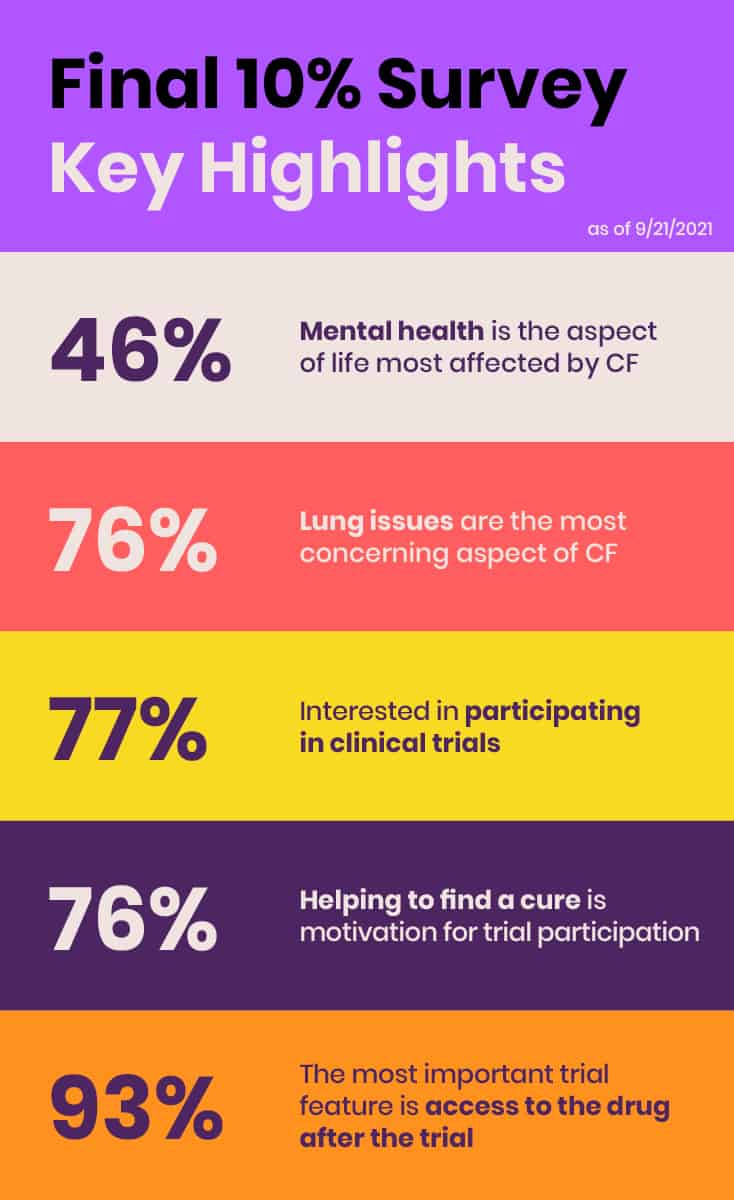
Die Umfrage ist ein weiteres Beispiel dafür, wie EE den Bedarf ermittelt und kritische Lücken schließt. Obwohl die Umfrage ursprünglich dazu gedacht war, die Erzählungen der sechs Mitglieder der CF-Gemeinschaft auf der FDA-Hörsitzung mit einigen grundlegenden quantitativen Daten zu ergänzen, wurde schnell klar, dass ihr Wert viel größer und umfassender war. Die Umfrage war mit 431 Teilnehmern aus 29 Ländern auf fünf Kontinenten sehr gut besucht. EE plante, die Ergebnisse in einer von Fachleuten begutachteten Zeitschrift zu veröffentlichen, um sicherzustellen, dass diese Daten der Öffentlichkeit in vollem Umfang zugänglich sind.


