
- Hogar
- La historia de Emily
- Sobre nosotros
- Investigación
- Eventos
- Prensa y medios
- Tomar medidas
- Blog
- Contacto
- Donar

Defensa
Atención a las necesidades de los 10% finales
La defensa y representación de los 10% finales de la comunidad de la FQ es una parte fundamental de la misión de EE. Aunque EE se había ganado una merecida reputación a lo largo de los años por su eficaz defensa de la investigación y el desarrollo terapéutico para los 10% finales de la comunidad de la FQ, cada vez se era más consciente de su valor único en el espacio normativo, y específicamente con reguladores clave como la Food & Drug Administration (FDA).
En 2021, EE llevó su defensa a la FDA mediante celebración de una sesión de escucha de pacientes de la FDA. Fue un gran paso para la organización. El enfoque de defensa de EE siempre ha situado al paciente en el asiento del conductor, trabajando codo con codo con la comunidad científica. La asociación con la FDA en una sesión centrada específicamente en las necesidades no cubiertas del 10% final de la comunidad de la FQ reflejó la voz influyente y en expansión de EE en múltiples áreas primordiales en el desarrollo terapéutico, incluido el espacio normativo.

Las Sesiones de Escucha de Pacientes de la FDA son pequeñas reuniones informales, cerradas al público, en las que los grupos de defensa de los pacientes hablan con el personal de la FDA sobre su experiencia de vivir y tratar una enfermedad. Los objetivos de la sesión de escucha de EE eran compartir y humanizar las necesidades terapéuticas urgentes e insatisfechas que siguen existiendo para el 10% final de la comunidad de la FQ; establecer una relación sólida con la FDA para fomentar la priorización y la aceleración de las revisiones y aprobaciones reglamentarias en el futuro; y garantizar que las perspectivas de la comunidad de la FQ se incluyan en todas las fases de los procesos de desarrollo y aprobación de fármacos.
En la reunión, EE informó al personal de la FDA sobre EE, la FQ y el 10% restante de la comunidad de FQ que no se beneficia de los moduladores CFTR actualmente disponibles, incluidos aquellos con mutaciones sin sentido de la FQ. En el acto intervinieron un médico y seis miembros de la comunidad de la FQ, entre ellos personas con FQ, padres y hermanos de personas con FQ y el padre de una persona con FQ fallecida, que compartieron su experiencia con la enfermedad. Estas historias tan personales y sentidas ayudaron a transmitir a la FDA la urgencia de buscar tratamientos para los 10% restantes de la comunidad con FQ.
Historias destacadas en las sesiones de escucha de la FDA:
Como parte de la sesión de escucha de la FDA, los participantes escucharon a seis miembros de la comunidad de fibrosis quística, entre ellos Abhijit Tirumala, un estudiante universitario de 19 años con fibrosis quística. En su testimonio, Abhijit explicó cómo la fibrosis quística afecta a su salud mental y cómo cambiaría su vida si un nuevo fármaco pudiera reducir su dependencia de tratamientos y medicamentos diarios.

En junio de 2021, EE llevó a cabo su primera encuesta exhaustiva y global de los aproximadamente 10% de individuos de la comunidad de FQ que no se benefician de los moduladores CFTR actualmente disponibles debido a mutaciones no elegibles, efectos secundarios o falta de acceso. El propósito de la encuesta "Final 10%" era recopilar información sobre el estado de salud, el impacto de la FQ, las necesidades de tratamiento no cubiertas y las preferencias de investigación clínica de aquellos que no se benefician de los moduladores CFTR y presentar datos y resultados preliminares en la Sesión de Escucha de la FDA.
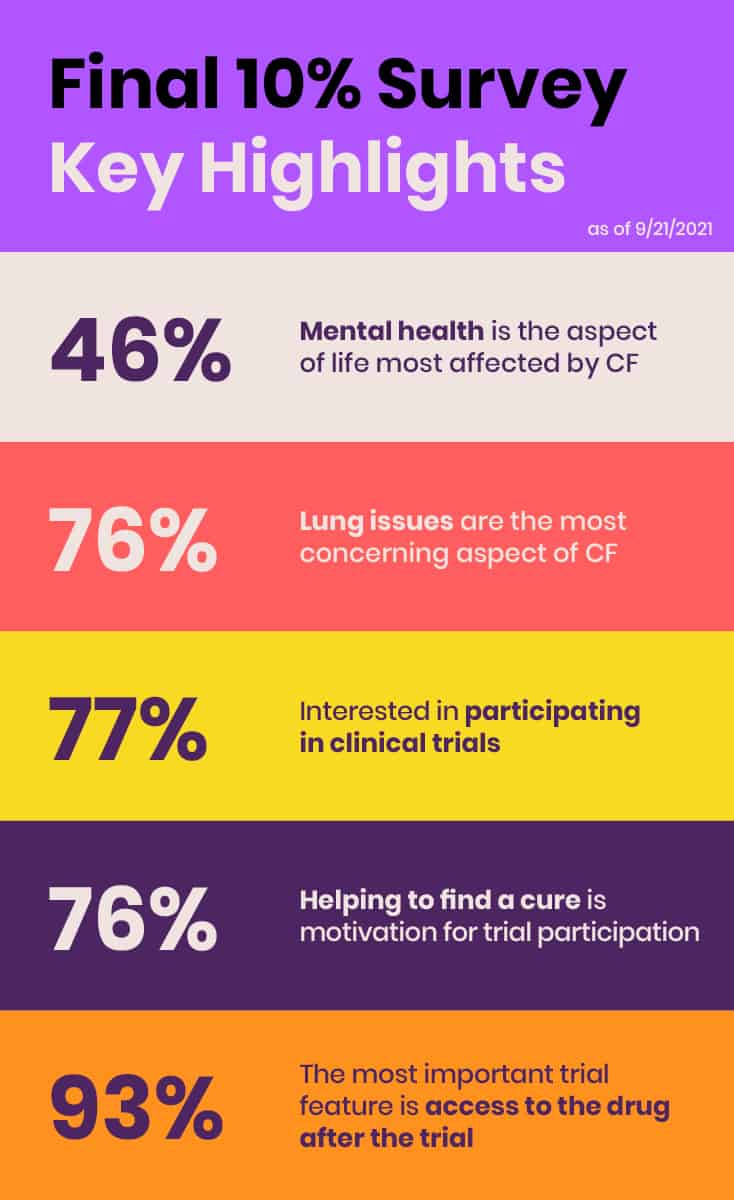
La encuesta es otro ejemplo de cómo EE identifica necesidades y colma lagunas críticas. Aunque en un principio la encuesta pretendía complementar los relatos de los seis miembros de la comunidad de FC en la sesión de escucha de la FDA con algunos datos cuantitativos básicos, pronto quedó claro que su valor era mucho mayor y más amplio. La encuesta obtuvo una gran respuesta, con 431 participantes de 29 países de los cinco continentes. EE tiene previsto publicar los resultados en una revista revisada por expertos para garantizar que estos datos estén a disposición del público.


