
- Casa
- La storia di Emily
- Chi siamo
- Ricerca
- Eventi
- Stampa e media
- Agire
- Blog
- Contatto
- Donare

Difesa
Evidenziare le esigenze della finale 10%
La difesa e la rappresentanza dei 10% finali della comunità FC sono una parte fondamentale della missione di EE. Se nel corso degli anni EE si è guadagnata una meritata reputazione per l'efficace sostegno alla ricerca e allo sviluppo terapeutico di coloro che fanno parte dell'ultimo 10% della comunità FC, si è sempre più diffusa la consapevolezza del suo valore unico nello spazio normativo e, in particolare, nei confronti di enti regolatori chiave come la Food & Drug Administration (FDA).
Nel 2021, EE ha portato il suo patrocinio alla FDA ospitare una sessione di ascolto dei pazienti dell'FDA. Questo è stato un passo importante per l'organizzazione. L'approccio di EE all'advocacy ha sempre messo il paziente al posto di guida, lavorando fianco a fianco con la comunità scientifica. La collaborazione con la FDA per una sessione specificamente incentrata sui bisogni insoddisfatti dell'ultimo 10% della comunità FC riflette l'influenza e l'espansione della voce di EE in diverse aree fondamentali per lo sviluppo terapeutico, compreso lo spazio normativo.

Le sessioni di ascolto dei pazienti della FDA sono piccole riunioni informali, chiuse al pubblico, in cui i gruppi di difesa dei pazienti parlano con il personale della FDA della loro esperienza di convivenza e gestione di una malattia. Gli obiettivi della sessione di ascolto dell'EE erano: condividere e umanizzare le urgenti esigenze terapeutiche non soddisfatte che rimangono per il 10% finale della comunità FC; costruire un forte rapporto con l'FDA per incoraggiare la definizione delle priorità e l'accelerazione delle revisioni normative e delle approvazioni in futuro; garantire che le prospettive della comunità FC siano incluse in ogni fase dei processi di sviluppo e approvazione dei farmaci.
Durante l'incontro, EE ha informato il personale della FDA su EE, sulla FC e sul restante 10% della comunità FC che non beneficia dei modulatori CFTR attualmente disponibili, compresi quelli con mutazioni nonsense della FC. L'evento ha incluso le osservazioni di un medico e di sei membri della comunità FC, tra cui persone con FC, genitori e fratelli di persone con FC e un genitore di una persona deceduta con FC, che hanno condiviso la loro esperienza di vita con la malattia. Queste storie profondamente personali e sentite hanno contribuito a trasmettere all'FDA l'urgenza di cercare trattamenti per i restanti 10% della comunità FC.
Storie evidenziate nelle sessioni di ascolto della FDA:
Nell'ambito della sessione di ascolto della FDA, i partecipanti hanno ascoltato sei membri della comunità FC, tra cui Abhijit Tirumala, uno studente universitario di 19 anni affetto da fibrosi cistica. Nel corso della sua testimonianza, Abhijit ha raccontato come la fibrosi cistica influisca sulla sua salute mentale e come cambierebbe la sua vita se un nuovo farmaco fosse in grado di ridurre la sua dipendenza da trattamenti e farmaci quotidiani.

Nel giugno 2021, EE ha condotto il primo sondaggio globale e completo sui circa 10% di individui della comunità FC che non beneficiano dei modulatori CFTR attualmente disponibili a causa di mutazioni non ammissibili, effetti collaterali o mancanza di accesso. Lo scopo dell'indagine "Final 10%" è stato quello di raccogliere informazioni sullo stato di salute, sull'impatto della FC, sulle esigenze di trattamento non soddisfatte e sulle preferenze di ricerca clinica di coloro che non beneficiano dei modulatori CFTR e di presentare i dati e i risultati preliminari alla sessione di ascolto della FDA.
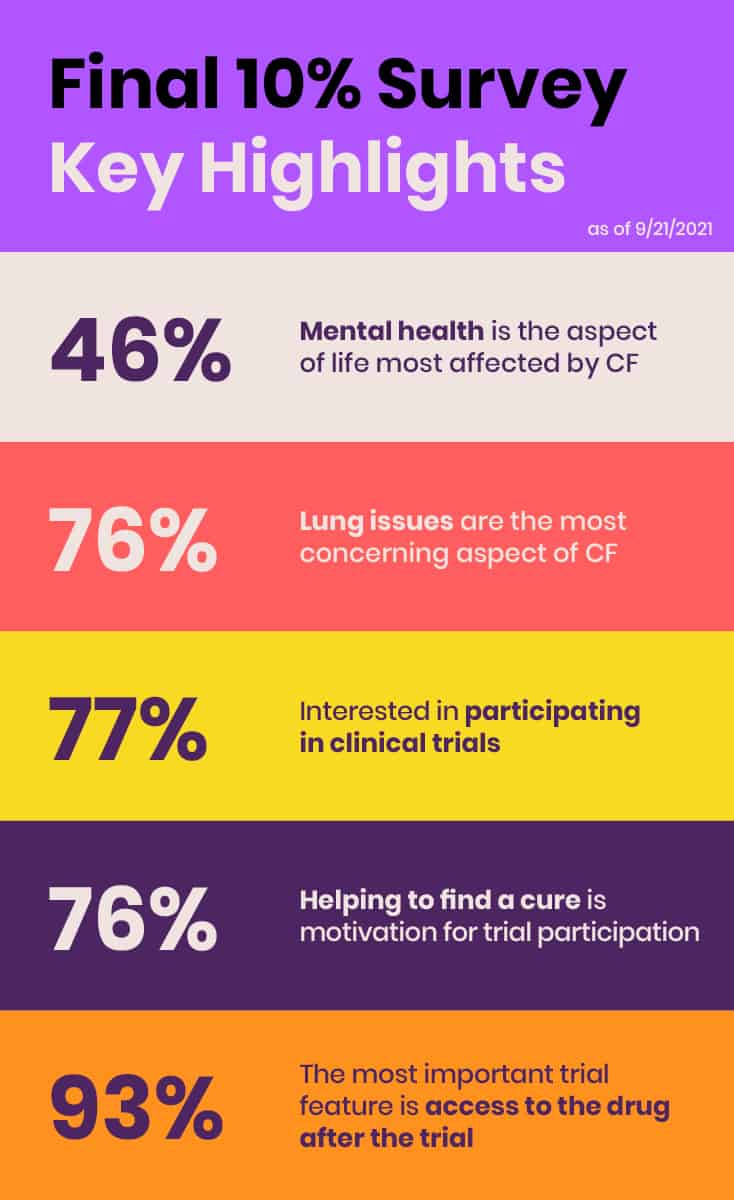
L'indagine è un altro esempio di come EE stia identificando i bisogni e colmando le lacune critiche. Sebbene inizialmente l'indagine fosse stata pensata per integrare le storie dei sei membri della comunità delle FC durante la sessione di ascolto della FDA con alcuni dati quantitativi di base, è apparso subito chiaro che il suo valore era molto più grande e più ampio. L'indagine ha ottenuto un'ampia risposta, con 431 intervistati provenienti da 29 Paesi di cinque continenti. EE ha pianificato la pubblicazione dei risultati su una rivista peer-reviewed per garantire che questi dati siano pienamente disponibili al pubblico.


